
La Chine a connu une augmentation significative des approbations de production de bio-similaires au cours des trois dernières années, avec 13 nouveaux bio-similaires* approuvés au cours de la période 2018-2021.
Un solide pipeline de bio-similaires et les dernières modifications réglementaires de la National Medical Products Administration (NMPA) devraient propulser le marché chinois des bio-similaires vers de nouveaux sommets, a déclaré GlobalData, une société de données et d’analyse de premier plan.
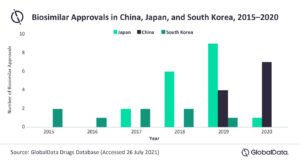
Avant 2019, la Chine n’avait pas de bio-similaires officiels disponibles. La récente augmentation des bio-similaires a aidé la Chine à devenir l’un des principaux marchés des bio-similaires en seulement trois ans, dépassant la Corée du Sud pour atteindre la deuxième place derrière le Japon, en termes de nombre d’approbations en 2019.
Quentin Horgan, analyste principal de la base de données sur les médicaments chez GlobalData, a expliqué que «la Chine a stimulé son marché des bio-similaires grâce à la mise en œuvre de nouvelles législations et réglementations par la NMPA. En 2015, la NMPA a publié les premières directives pour une voie bio-similaire établie en Chine».
Cette nouvelle voie réglementaire a créé des réglementations standardisées pour le développement et l’évaluation des bio-similaires, clarifiant la définition des bio-similaires et établissant des normes pour la R&D préclinique, les essais cliniques et la fabrication, facilitant ainsi le développement et l’approbation des bio-similaires.
Quentin Horgan a indiqué que «de plus, la NMPA a apporté de nombreux changements réglementaires pour réduire les coûts et les obstacles pour les entreprises réalisant de la R&D sur les produits biologiques. Ceci, parallèlement aux nouvelles directives sur les bio-similaires, conduit les approbations chinoises de bio-similaires à une croissance remarquable».
En février 2019, le premier bio-similaire officiel chinois, le bio-similaire rituximab HLX01, a été approuvé. Il est développé par Shanghai Henlius Biopharmaceutical pour le traitement du lymphome non hodgkinien (LNH).
Trois autres bio-similaires ont été approuvés en Chine en 2019, et 7 bio-similaires ont été approuvés en 2020, soit une augmentation de 75 % entre 2019 et 2020. Il y a déjà eu deux approbations de bio-similaires en Chine au premier semestre 2021.
Un bio-similaire du bevacizumab de Luye Pharma Group Ltd a été approuvé en mai 2021 pour le cancer du poumon non à petites cellules, et un bio-similaire de l’infliximab par Mabpharm Ltd a été approuvé en juillet 2021 pour la spondylarthrite ankylosante (maladie de Bekhterev).
Pour Quentin Horgan, «l’augmentation du nombre de bio-similaires chinois devrait se poursuivre dans le futur, avec 11 médicaments bio-similaires actuellement en pré-enregistrement et en attente d’approbation par la NMPA, ainsi qu’environ 100 bio-similaires en préparation».
*Les médicaments bio-similaires sont des médicaments produits par biotechnologie dont le brevet a expiré. On peut citer ainsi certains ménotropines, constitués à base de gonadotrophine ou l’enoxaparine.
**Un pipeline est un ouvrage destiné à transporter, sous pression et sur de grandes distances, des matières fluides (liquides, gaz, mélanges polyphasiques).
***Image de Une : image d’illustration