La concentration globale de la Chine dans la recherche en oncologie augmente à un rythme rapide. De plus, la Chine a récemment approuvé sa première thérapie cellulaire par récepteur d’antigène chimérique (CAR)-T.
Dans ce contexte, les sociétés pharmaceutiques nationales chinoises se trouvent à l’avant-garde des essais de thérapie cellulaire CAR-T parrainés par l’entreprise et sont susceptibles de dominer le paysage CAR-T, a déclaré GlobalData, une société de données et d’analyse de premier plan.
 La National Medical Products Administration (NMPA) a récemment approuvé deux demandes initiales de nouveau médicament (IND) pour le CT120 d’IASO Biotherapeutics, une thérapie cellulaire CAR-T à double cible CD19/CD22 entièrement humaine, pour le traitement des rechutes CD19/CD22 positives. /lymphome non hodgkinien à cellules B réfractaire (r/r B-NHL) et leucémie aiguë lymphoblastique à cellules B en rechute/réfractaire (r/r B-ALL).
La National Medical Products Administration (NMPA) a récemment approuvé deux demandes initiales de nouveau médicament (IND) pour le CT120 d’IASO Biotherapeutics, une thérapie cellulaire CAR-T à double cible CD19/CD22 entièrement humaine, pour le traitement des rechutes CD19/CD22 positives. /lymphome non hodgkinien à cellules B réfractaire (r/r B-NHL) et leucémie aiguë lymphoblastique à cellules B en rechute/réfractaire (r/r B-ALL).
Sasmitha Sahu, analyste pharmaceutique chez GlobalData, a expliqué que «dans la continuité de son objectif de renforcer la R&D en oncologie, la Chine continue d’ajouter des thérapies CAR-T, les dernières étant des thérapies CAR-T à double cible, à son pipeline d’essais cliniques. Bien que le CD19 ciblant les thérapies oncologiques commercialisées par CAR-T ait été adopté avec succès, il existe encore des besoins non satisfaits, tels que la durabilité de la rémission et la prévention de la fuite des antigènes tumoraux. Par conséquent, la recherche sur les thérapies CAR-T à double cible comme CD19/CD22, CD19/20 et CD19/BCMA a attiré l’attention».
En juin 2021, la Chine a approuvé son premier traitement CAR-T, Yescarta (FKC876/axicabtagene ciloleucel/axi-cel), de la filiale chinoise de Gilead, FosunKite, pour le traitement du LNH chez les adultes. C’était le deuxième pays asiatique après le Japon, qui l’a approuvé en janvier 2021. Axi-cel a été approuvé pour la première fois aux États-Unis et dans l’UE en 2017 et 2018, respectivement.
Le Japon et Singapour sont les deux seuls pays asiatiques à avoir approuvé le tisagenlecleucel en mars 2019 et mars 2021, respectivement. En revanche, le lisocabtagene n’a été approuvé qu’au Japon en mars 2021.
Sasmitha Sahu a souligné que «l’approbation par la Chine de sa première thérapie CAR-T Yescarta intervient un peu plus tard que l’approbation du Japon. Néanmoins, il s’est montré prompt à fournir une deuxième désignation révolutionnaire pour le traitement du LNH indolent en rechute ou réfractaire après avoir reçu un traitement systémique de deuxième intention ou supérieur (r/riNHL), y compris le lymphome folliculaire et le lymphome de la zone marginale pour axi-cel».
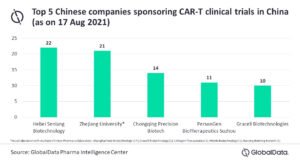
Selon le GlobalData Pharma Intelligence Center, il existe 337 essais thérapeutiques CAR-T parrainés par l’entreprise en Chine.
Bien que les thérapies CAR-T fassent indéniablement passer la thérapie anticancéreuse au niveau supérieur, les coûts énormes suscitent une inquiétude croissante.
Sasmitha Sahu a souligné que «la Chine soutenant de plus en plus l’entrée de sociétés pharmaceutiques nationales dans l’espace CAR-T, la probabilité de succès des thérapies CAR-T sur le marché est plus grande. En outre, de nouveaux programmes potentiels d’assistance aux patients et de nouveaux modèles de paiement pour alléger le fardeau financier devraient rendre ces thérapies abordables et accessibles pour les patients en Chine».