
Le développement d’inhibiteurs de points de contrôle immunitaires (ICI) a été au centre de la stratégie de R&D de la Chine, ces agents coûteux étant utilisés dans un nombre croissant d’indications en oncologie.
Plusieurs ICI développés au niveau national ont maintenant obtenu l’approbation de la National Medical Products Administration, et plusieurs autres sont en phase de pré-enregistrement, en attente d’approbation réglementaire. Cependant, les inquiétudes concernant la diversité de leurs essais cliniques, la conduite des essais cliniques et le manque de bras de comparaison approprié seront des obstacles majeurs à leur approbation en Occident, selon GlobalData, une société de données et d’analyse de premier plan.
Le marché chinois, en raison de sa grande population, a toujours fourni une troisième vague de revenus lucrative pour les médicaments développés en Occident après leur commercialisation aux États-Unis et en Europe.
Cependant, des investissements importants du gouvernement chinois, associés à une réforme de la réglementation et à des partenariats internationaux, ont conduit au développement de plusieurs agents chinois développés au niveau national au cours des dernières années, générant une concurrence substantielle pour les médicaments développés en Occident.
Avigayil Chalk, PhD, analyste en oncologie et hématologie chez GlobalData, a expliqué que « les ICI de deuxième génération développés au niveau national offrent un avantage de prix significatif par rapport aux équivalents de première classe développés en Occident, car leur inclusion dans la liste nationale des médicaments remboursés résulte en rabais substantiels ».
« Pour obtenir une part de marché dans ce paysage concurrentiel, les ICI développés en Occident doivent avoir des prix compétitifs, en équilibrant la perte de marge bénéficiaire avec une très large population cible. Le marché chinois devrait être une source décroissante de revenus ICI pour les sociétés pharmaceutiques occidentales dans les années à venir », selon l’analyte de GlobalData
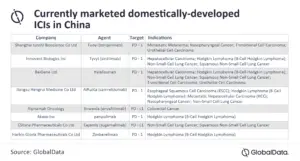
« La question croissante à laquelle sont confrontées les sociétés pharmaceutiques occidentales est de savoir si les ICI chinois développés au niveau national obtiendront l’approbation et seront également une source de concurrence sur les marchés américain et européen. Ces dernières années, de multiples partenariats internationaux ont été établis entre des sociétés pharmaceutiques occidentales et chinoises (tableau 2), dans le but de commercialiser des agents chinois développés localement sur ces marchés », a indiqué Avigayil Chalk.

Les conclusions de la récente audience du Comité consultatif sur les médicaments oncologiques (ODAC) de la FDA, qui a évalué le sintilimab d’anticorps anti-PD-1 d’Eli Lilly et Innovent, ont mis en évidence les obstacles importants à l’approbation par la FDA des ICI développés en Chine.
L’ODAC a presque unanimement recommandé de ne pas approuver le sintilimab pour le traitement du cancer du poumon non à petites cellules sur la base de l’essai de phase III ORIENT-11. Des préoccupations importantes ont été soulevées concernant la diversité des essais cliniques, la conduite des essais cliniques et la garantie d’un bras de comparaison approprié.
Avigayil Chalk a ajouté que « ces obstacles importants seront rencontrés par toute collaboration sino-occidentale cherchant à obtenir l’approbation de la FDA pour un ICI. Le résultat de l’audience démontre que l’approbation de la FDA ne peut généralement pas être obtenue sur la base d’essais menés exclusivement en Chine, car les participants ne reflètent pas la diversité de la population américaine ».
De plus, la norme de soins (SOC) dans la plupart des contextes d’oncologie en Chine étant souvent en retard de plusieurs années sur la SOC aux États-Unis, la question du bon bras de comparaison a également été soulevée par l’ODAC.
L’analyste a estimé que « pour que les ICI chinois développés au niveau national soient en mesure de réduire les prix des ICI occidentaux sur les marchés américain et européen, des essais dans une population « semblable aux États-Unis » seront nécessaires. La collaboration pharmaceutique occidentale et chinoise au début du développement de médicaments semble être une clé importante pour obtenir l’approbation de la FDA, permettant la mise en place d’essais dans une population diversifiée «semblable aux États-Unis ».
« Le scepticisme sur l’intégrité des essais sera également surmonté par des partenariats permettant des sites et des protocoles d’essais aux États-Unis. Alors que les ICI chinois peuvent changer le paysage de l’industrie pharmaceutique occidentale« , GlobalData a souligné que « la voie d’approbation de ces agents sera difficile, ce qui pourrait faire grimper le prix de ces agents de deuxième génération, réduisant ainsi leur avantage concurrentiel ».